目前,鱼类病毒病的防控是我国水产养殖业持续、健康发展面临的重大难题,阐明鱼类抗病毒感染的遗传机制、培育抗病鱼类新品种是我国水产科学的重要研究方向。鱼类与哺乳类相比,其获得性免疫系统欠发达,免疫记忆较弱,因此,开发鱼类病毒病的疫苗仍存在很大困难。然而,鱼类天然免疫系统完备、发达,是抵御病原体感染的第一道防线,在鱼类抗病毒感染过程中起着至关重要的作用。
中国科学院水生生物研究所肖武汉团队利用多组学技术,筛选到一系列调控鱼类抗病毒天然免疫反应的重要因子,其中包括精氨酸甲基转移酶PRMT3。初始研究发现:PRMT3的表达受病毒感染的调控,而PRMT3又负调控抗病毒天然免疫信号通路,抑制I型干扰素的产生和抗病毒基因的表达。随后,该团队利用基因编辑技术制备了prmt3缺失的斑马鱼。通过病毒攻毒实验发现:prmt3 缺失的斑马鱼与野生型斑马鱼相比,其体内病毒复制明显减少,抗病毒感染的能力增强,存活率显著提高。而prmt3缺失的斑马鱼在生长、发育和繁殖等方面与野生型斑马鱼相比,无任何差异,因此,prmt3是培育抗病鱼类新品种的理想获选靶标(Zhu et al., FASEB Journal, 2020)。
在此基础上,该团队进一步系统解析了PRMT3调控抗病毒天然免疫反应的分子机制。研究发现:细胞在非病毒感染的静息状态,PRMT3与胞质RNA病毒感受器RIG-I、MDA5和胞质DNA病毒感受器cGAS相互作用,分别催化RIG-I和MDA5上保守的第730位精氨酸(R730)和第822位精氨酸(R822)以及cGAS上第111位精氨酸(R111)的不对称二甲基化。这些甲基化修饰不仅抑制了RIG-I和MDA5与RNA的结合能力,而且抑制了cGAS与DNA的结合能力,并阻止cGAS的寡聚化激活,达到避免机体发生过度免疫反应的目的。然而,细胞在感染RNA病毒或DNA病毒后,PRMT3与RIG-I、MDA5以及cGAS结合能力减弱,其所催化的精氨酸甲基化修饰水平也随之下降,从而促进RIG-I、MDA5与RNA以及cGAS与DNA的结合,激活其下游抗病毒天然免疫反应,促进I型干扰素的产生和抗病毒基因的表达。在体研究表明:缺失一个Prmt3拷贝的小鼠或PRMT3抑制剂SGC707处理后的小鼠,对RNA和DNA病毒感染的抵抗力显著增强,存活率增高,这不仅证实了PRMT3在调控抗病毒天然免疫反应中的重要作用,而且还表明了其功能在脊椎动物中的保守性。该研究不仅对细胞质RNA和DNA病毒传感器激活的分子机制提供了新的见解,而且为进一步利用prmt3来培育抗病鱼类新品种提供了理论支撑。
8月28日,肖武汉团队在《美国科学院院刊》(PNAS)上,在线发表了题为“Asymmetric arginine dimethylation of cytosolic RNA and DNA sensors by PRMT3 attenuates antiviral innate immunity”的研究论文。该研究得到了中国科学院战略性先导专项A、国家自然科学基金创新群体项目、国家自然科学基金重点项目和重点研发计划“蓝色粮仓”项目的资助。
论文链接:https://www.pnas.org/doi/epdf/10.1073/pnas.2214956120
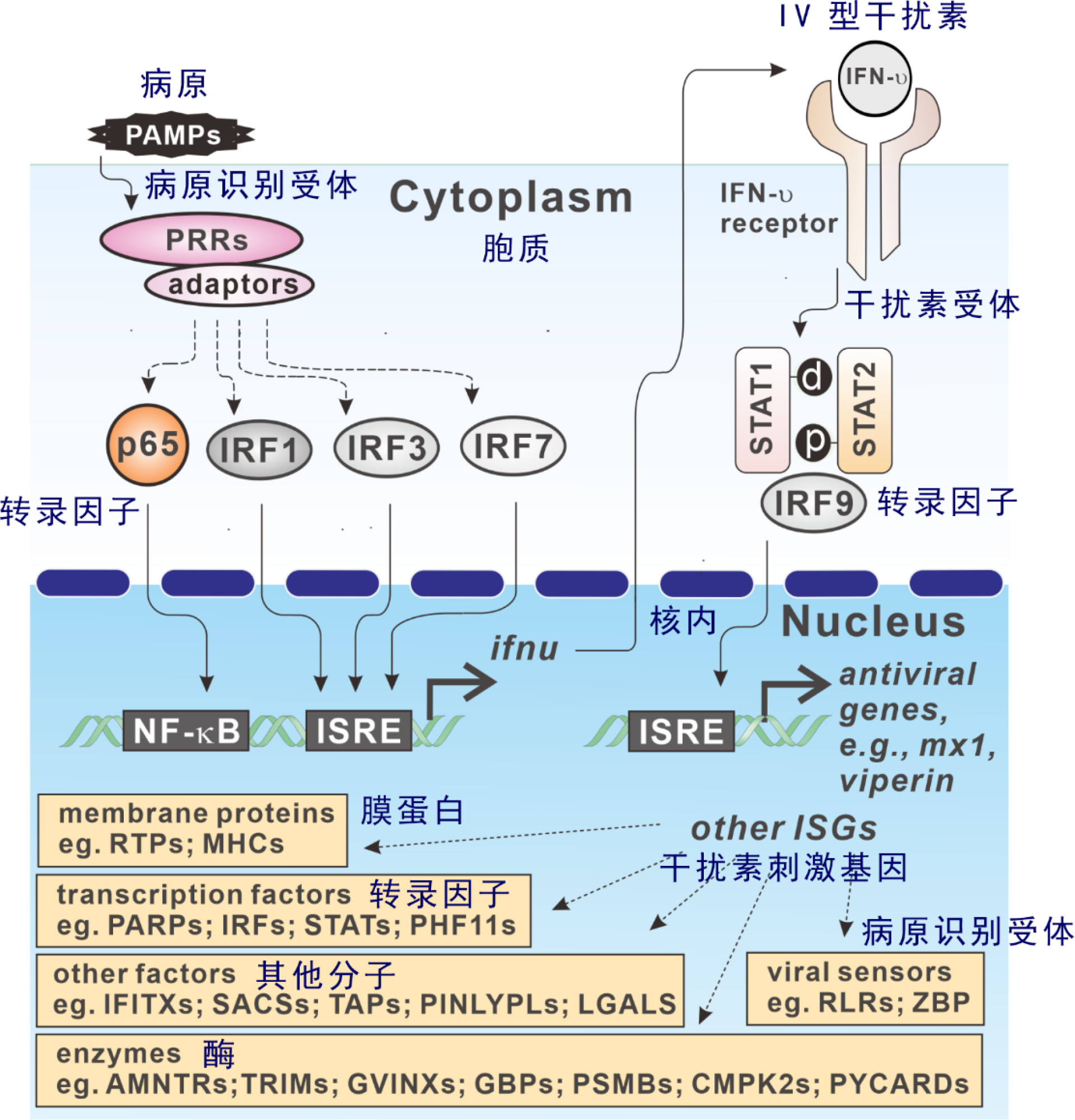 PRMT3 催化RIG-I,MDA5和cGAS的精氨酸甲基化,抑制抗病毒天然免疫反应
PRMT3 催化RIG-I,MDA5和cGAS的精氨酸甲基化,抑制抗病毒天然免疫反应
来源:中国科学院水生生物研究所


